La modélisation consiste à représenter les interactions entre différents types de molécules par des expressions analytiques. On parle alors de modélisation moléculaire. Cette technique est utilisée abondamment dans les laboratoires de recherche, y compris industrielle.
Cette technique peut être étendue à la prévision de propriétés qui sont directement impliquées dans la sûreté du stockage du dioxyde de carbone. Une des propriétés fondamentales est la tension interfaciale qui existe entre la phase liquide (eau) et la phase gazeuse ou liquide (CO2).
La tension interfaciale n’est autre que la différence d’énergie entre la phase liquide et la phase gazeuse rapportée à l’aire de l’interface.


Zoom sur l'interface CO2-H2O (source LTIM, Université Blaise Pascal, Clermont-Ferrand)
Une des bases des méthodes de simulation moléculaire est de rendre l’énergie entre deux molécules dépendante de la distance les séparant. Pour modéliser correctement cette énergie intermoléculaire, il faut prendre en compte les contributions suivantes :
- L’énergie de répulsion, qui dépend de la distance en 1/r12, avec r la distance entre les deux molécules. Cette énergie a pour but d’éviter que deux molécules puissent s’approcher trop près l’une de l’autre.
- L’énergie d’attraction, en -1/r6, a pour but d’attirer des molécules lorsque leur distance est trop importante.
- L’énergie électrostatique, en 1/r, modélise l’énergie coulombienne entre deux molécules chargées.
L’ensemble de ces trois contributions est représenté sur les figures a et b ci-dessous.
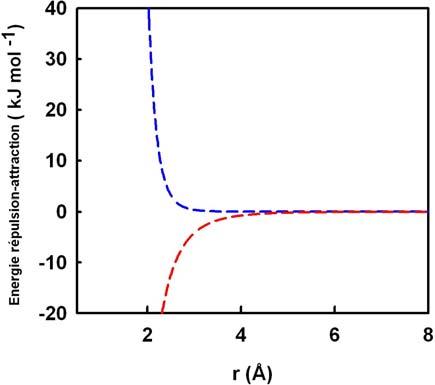
a. Energies répulsive et attractive en fonction de la distance entre deux molécules
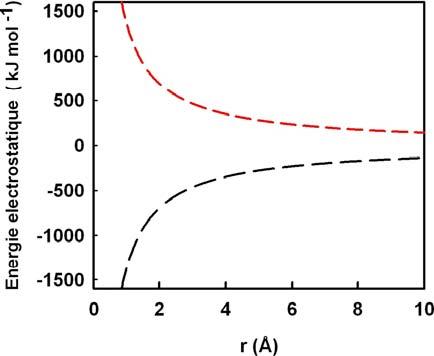
b. Energie électrostatique en fonction de la distance entre deux molécules
La courbe rouge représente l’énergie entre deux charges de même signe,
et la courbe noire, entre deux charges opposées
Modélisation de la tension interfaciale
Pour représenter la phase liquide, il suffit de modéliser un grand nombre de molécules d’eau, et pour représenter la phase gazeuse, un grand nombre de molécules de CO2. Les deux phases sont mises en contact et on calcule les énergies. On accède alors directement à la différence d’énergie entre la phase liquide et gazeuse (tension interfaciale).
Il suffit de refaire les calculs à différentes pressions pour avoir la dépendance de la tension interfaciale en fonction de la pression. La comparaison avec l’expérience (figure c) montre que la prédiction des modèles est fiable. Cela signifie que ces méthodes peuvent être étendues à d’autres systèmes, d’autres températures et d’autres pressions. Et ainsi remplacer l’expérience plus coûteuse et dangereuse (pression 500 fois supérieure à la pression atmosphérique => tout peut exploser). A titre indicatif, une modélisation du système H2O-CO2 prend trois semaines de calcul sur les ordinateurs actuels.

c. Tension interfaciale en fonction de la pression
Le CO2 capturé dans les fumées industrielles contient parfois d’autres gaz : CH4 (méthane) et H2S (sulfure d’hydrogène). Modéliser les conditions sous-marines avec de l’eau et du dioxyde de carbone est une première approximation. Il faut améliorer les modèles pour prendre en compte des mélanges de gaz CO2, CH4 et de l’eau salée H2O+Na++Cl-. Ces différents mélanges peuvent avoir un impact sur la valeur de la tension interfaciale.